Metabolički putovi regulirani su hormonima, redoks signalizacijom, kovalentnim modifikacijama proteina, hranidbom, drugim čimbenicima okoliša te unutarstaničnim koncentracijama supstrata i metabolita. Svi ovi čimbenici ključni su za rast, razvoj, imunitet, proizvodnju, zdravlje i općenito preživljavanje životinja.
Budući da metabolička kontrola putem kratkoročnih i dugoročnih mehanizama pomaže životinjama da se prilagode hranidbenim, fiziološkim i okolišnim promjenama, individualne reakcije, biokemijski putovi i acidobazne ravnoteže dobro su integrirani za održavanje fiziološke homeostaze u zdravim organizmima. Poremećaji homeostaze tijekom duljeg vremenskog razdoblja mogu rezultirati bolešću. Bolest se definira kao poremećaj strukture ili funkcije u tijelu koji se obično očituje specifičnim znakovima i simptomima.
U životinja metabolički poremećaji (uključujući metaboličke bolesti) nastaju zbog jednog ili više od sljedećih razloga. To su nekvalitetna hranidba; neadekvatan ili prekomjeran unos hranjivih tvari; smetnje u probavi, apsorpciji, korištenju ili skladištenju hranjivih tvari; neravnoteže i antagonizmi među hranjivim tvarima; prekomjerno izlučivanje neiskorištenih hranjivih tvari; povećane potrebe stanica, tkiva ili cijelog tijela za hranjivim tvarima zbog fizioloških ili ekoloških promjena; abnormalna metabolička kontrola; dehidracija te toksina u okolišu i hrani.
Dakle, metabolički poremećaji uključuju, ali nisu ograničeni na, hranidbene ili stečene bolesti, iako su potonje obično u fokusu stručnjaka u stočarstvu. Karakteristični sindromi (npr. gušavost zbog nedostatka joda ili metastatska kalcifikacija zbog prekomjernog kalcija) mogu se potaknuti eksperimentalno induciranjem manjka ili viška pojedinih nutrijenata. Na farmama, metabolički poremećaji često su posljedica istodobnih nedostataka ili viška više hranjivih tvari. Obično su povezani s bakterijskim, gljivičnim, virusnim ili parazitskim infekcijama.
Dijabetes
Dijabetes tipa I nastaje zbog razaranja b-stanica gušterače. To dovodi do nedostatka inzulina, a dijabetes melitus tipa II zbog smanjene osjetljivosti tkiva na inzulin. Hiperglikemija uzrokuje oksidativni stres, što dovodi do oštećenja mrežnice, sljepoće, smanjenog protoka krvi i slabosti mišića. Dijabetes je rijedak kod životinja koje se koriste za proizvodnju hrane. Zbog prekomjernog hranjenja i tjelesne neaktivnosti čest je kod kućnih ljubimaca (npr. mačaka i pasa).
Ometanje autoimune aktivacije makrofaga ili inhibicija otpuštanja upalnih molekula od strane ovih stanica putem dijetetskih ili terapijskih sredstava (npr. oralna primjena inhibitora glutaminaze ili inhibitora NO sintaze; konzumacija hrane temeljene na kazeinu) može spriječiti ili odgoditi dijabetis tipa I. Inzulin se mora koristiti za liječenje dijabetes melitusa tipa I. Smanjenje prekomjernog nakupljanja masti u tkivima kroz kontrolu unosa masti i škroba hranom te poboljšanje osjetljivosti tkiva na inzulin kroz povećano kretanje i korištenje specifičnih dodatak obrocima učinkoviti su u smanjenju koncentracije glukoze u krvi životinja, s dijabetes melitusom tipa II.

Hipoglikemija
Ovaj poremećaj nastaje kad je razina glukoze unesene hranom i endogena sinteza niža od razine iskorištenja glukoze u životinja. Kod preživača nedostatak vitamina B12 (vitamina potrebnog za pretvaranje propionata u glukozu) također dovodi do hipoglikemije. Kod drugih vrsta, npr. svinja, koje imaju samo 1% masti u tijelu pri rođenju i nemaju sposobnost sintetiziranja ketonskih tijela (glavno metaboličko goriva za mozak kad je koncentracija glukoze u krvi niska), hipoglikemija je prvenstveno odgovorna za smrt novorođenčadi, posebno onih izloženim niskim temperaturama.
Sinteza glukoze ne zahtijeva samo supstrate (aminokiseline, laktat i glicerol), već i energiju i NADH. Prema tome, neadekvatan unos hranjivih tvari doprinosi hipoglikemiji kod svih vrsta životinja. Nadalje, kad životinje konzumiraju hranjive tvari koje inhibiraju b-oksidaciju masnih kiselina u jetri i bubrezima, organa koji su sposobni za glukoneogenezu, također se javlja hipoglikemija. Dovoljna opskrba škrobom, masnim kiselinama, aminokiselinama, vitaminima i mineralima u obrocima, uz držanje životinja u termo-ugodnom okruženju, te izbjegavanje toksičnih tvari, ključni su za prevenciju i liječenje hipoglikemije.
Ruminalna acidoza u preživača
Visok sadržaj škroba i monosaharida u obrocima preživača temeljenih na žitaricama rezultira naglim smanjenjem pH ruminalne (buražne) tekućine, zbog brze proizvodnje mliječne kiseline iz visoko probavljivih ugljikohidrata od strane mikroba putem glikolize, što dovodi do metaboličke acidoze u buragu (ruminalni pH < 5,5). Nizak pH u buragu inhibira rast celulolitičkih bakterija i bakterija koje proizvode acetat, ali potiče rast bakterija koje proizvode propionat u buragu. Time se smanjuje probava grubih, voluminoznih krmiva i proizvodnja acetata, ali potiče stvaranje propionata. Dakle, obroci za preživače trebaju sadržavati < 45% ugljikohidrata bez vlakana u ST (koncentrata) te moraju sadržavati dovoljno voluminoza i grubih krmiva za održavanje buraga u zdravom stanju.
Buražna nadutost (ruminalna timpanija) u preživača
U burag preživača se mikrobnom fermentacijom hranjivih tvari (uglavnom ugljikohidrata), proizvodi velika količina plinova, prvenstveno CO2 i CH4. Kad brzina stvaranja plinova premašuje brzinu njihove eliminacije eruktacijom (podrigivanjem), u slučaju pjenaste nadutosti ili kad plinovi ne mogu izaći zbog začepljenja jednjaka ili inhibicije živaca koji kontroliraju kontrakcije stijenke buraga, plinovi (oko 95%) s vodom stvaraju pjenu, u prisutnosti površinski aktivnih komponenti. Potonji, koji imaju i hidrofilna i hidrofobna svojstva, uključuju fosfolipide, glikolipide, lipopolisaharide podrijetlom su iz biljaka ili bakterija, kao i hidroksilirane i umrežene masne kiseline (mikolne kiseline) u buragu.
Pjene su stabilizirane proteinima topivim u vodi, izvanstaničnim polimernim tvarima (uglavnom mukopolisaharidi), dvovalentnim ionima (Ca2+ i Mg2+) i suspendiranim biljnim česticama male veličine. Ovi čimbenici povećavaju viskoznost tekućine buraga. Brza fermentacija visoko probavljivih tvari (npr. mono- i oligosaharida, repinih rezanaca i melase) također akutno smanjuje pH tekućine u buragu. Tako dodatno oštećuje pokretljivost buraga i uklanjanje plinova. Veliki volumen pjene stvara unutarnji pritisak na vitalne organe (npr. srce i pluća). To dovodi do disfunkcije više organa (npr. krvožilnog i respiratornog) i na kraju do smrti životinja.
Upravljanje pašom ili hranidbom općenito, vrlo je učinkovito za sprječavanje nadutosti preživača u životinja na paši ili ako im je dostupna voluminozna krma neograničeno, po volji. Na primjer, korištenje pašnjaka miješanih vrsta pašnjačkih mahunarki i trava (koje sadrže visok sadržaj vlakana) s najviše do 50% lucerne (ili djeteline) na pašnjaku ili postupna prilagodba na obroke koji se sastoje od zrna žitarica i sušene krme. Kad se pjenasta nadutost pojavi, tretmani uključuju: uklanjanje plinova iz buraga kroz troakar ili kanilu; odstranjivanje buražnog sadržaja sondom; oralna primjena agensa protiv pjenjenja, kao što je biljno ili mineralno ulje (0,4 -0,5 l/grlu). Ono također smanjuje mikrobnu aktivnost, hitna rumenotomija te postavljanje buražne fistule za kratkotrajno odstranjenje plinova.

Metaboličke miopatije konja
Ovo stanje, također poznato kao rabdomioliza konja, azoturija ili bolest ponedjeljka ujutro, može biti posljedica prekomjerne proizvodnje laktata ili niskog pH u skeletnim mišićima konja koji vježbaju te neadekvatnog protoka krvi u mišiće. Sve to dovodi do grčeva mišića izazvanih hipoksijom i njihovim oštećenjem. Miopatija konja uzrokovana naporom vjerojatno je nasljedni poremećaj i potaknuta je višestrukim čimbenicima. To su prekomjerno hranjenje nestrukturnim ugljikohidratima (npr. žitaricama bogatim škrobom); loša kondicija ili kondicija; naglo povećanje opterećenja; neravnoteže elektrolita; nedostatak antioksidativnih minerala i vitamina; i nepoželjnih vremenskih uvjeta.
Kao preventivno sredstvo, smanjenje unosa škroba hranom (npr. ograničavanje konzumacije žitarica) ključno je za liječenje konja osjetljivih na miopatiju konja uzrokovanu naporom. Tretmani mogu uključivati uspostavljanje ravnoteže elektrolita i uklanjanje obroka žitarica; dodatak obrcima s argininom (prekursor NO kao glavni vazodilatator) i biljnim uljem (glavno metaboličko gorivo za skeletne mišiće); i ograničena tjelovježba plus hranidba s niskim udjelom ugljikohidrata i visokim udjelom masti kako bi se smanjila proizvodnja laktata i osigurala odgovarajuća proizvodnja ATP-a u skeletnim mišićima.
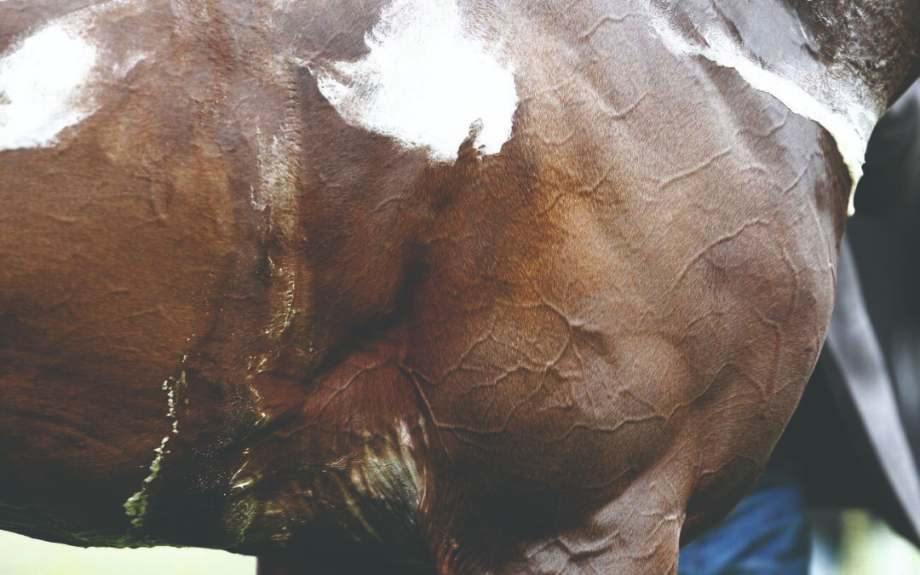
Proljevi novorođene prasadi hranjene saharozom
Saharaza hidrolizira saharozu (biljni disaharid) u glukozu i fruktozu. Međutim, ovaj enzim je potpuno odsutan u sluznici tankog crijeva prasadi pri rođenju i aktivan je tek nakon 7 dana starosti. Specifične i ukupne aktivnosti saharaze značajno se povećavaju nakon toga do 8. tjedna starosti. Stoga, kad se hrane velikom količinom saharoze, novorođena prasad je ne može probaviti. Njezin osmotski učinak privlači vodu iz sluznice tankog crijeva i krv u lumen tankog crijeva. To dovodi do stvaranja vodenastog digesta. Stoga bi hrana prasadi prije odbijanja trebala sadržavati malo saharoze.
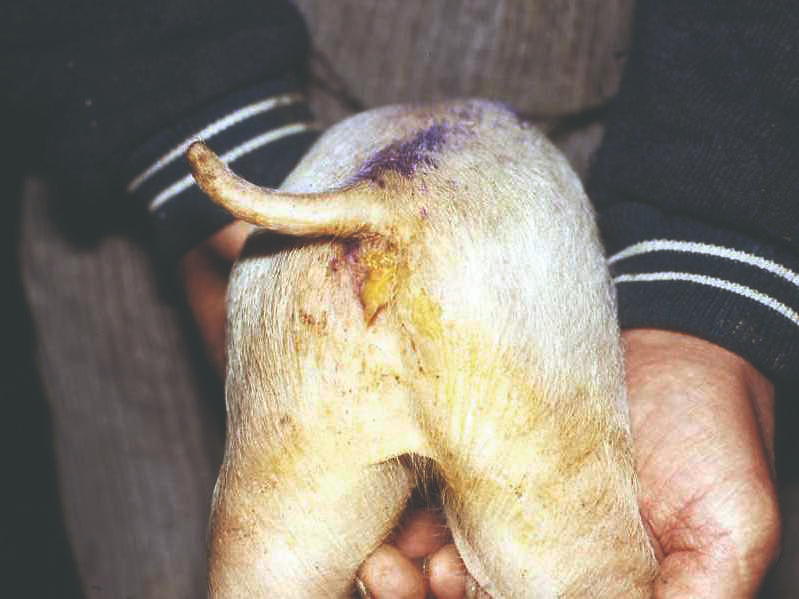
Sindrom nedostatka esencijalnih masnih kiselina
Linoleinska kiselina (Ω6, C18:2) i α-linolenska kiselina (Ω3, C18:3) su hranidbeno esencijalne masne kiseline za sve životinje. Kod mačaka, kojima nedostaje D6-desaturaza za pretvaranje linolne kiseline u arahidonsku kiselinu (Ω6, C20:4), arahidonska kiselina je također esencijalna masna kiselina. Kad se pojave nedostaci esencijalnih Ω3 i Ω6 masnih kiselina, životinje pokazuju brojne sindrome, uključujući kožne lezije, ograničenje rasta, reproduktivne poremećaje, povećanu osjetljivost na infekcije, trombocitopeniju, oštećenje neurološkog razvoja, loše zacjeljivanje rana i alopeciju (gubitak dlake). Hranidbeni dodaci s nedostatnim esencijalnim masnim kiselinama (npr. u buragu zaštićeni oblici, u slučaju preživača) mogu učinkovito spriječiti navedene sindrome.
Pretilost
Kronična neravnoteža između unosa i potrošnje energije kod životinje uzrokuje prekomjerno taloženje masti u tijelu. To dovodi do pretilosti, dislipidemije, inzulinske rezistencije i dijabetesa tipa II. Životinje za druženje (npr. psi, mačke i nedresirani konji) imaju veći rizik od pretilosti od ostalih domaćih životinja koje se uzgajaju za proizvodnju mesa ili mlijeka, u relativno mladoj dobi. Svinje nemaju smeđe masno tkivo i prirodno počinju nakupljati velike količine bijelog masnog tkiva počevši od 45 kg tjelesne mase (TM). Zanimljivo je da se čak i kad se svinje hrane hranom s niskim udjelom masti, njihova masnoća u trupu nesrazmjerno povećava za 10 puta između 45 i 115 kg TM.
Značajno nakupljanje tjelesne masti u tovnih goveda događa se samo kad se hrane (završnom) hranom koja se temelji na žitaricama (obično u tovilištima). Istraživane su brojne hranidbene strategije za regulaciju sadržaja masti kod domaćih životinja. Na primjer, povećanje unosa proteina i aminokiselina (npr. 1% dodatni arginin) može smanjiti taloženje masti kod životinja. Osim toga, kretanje životinja može spriječiti pretilost stimuliranjem 50-AMP-aktivirane protein kinaze (AMPK) signalizacije i povećanjem potrošnje energije.

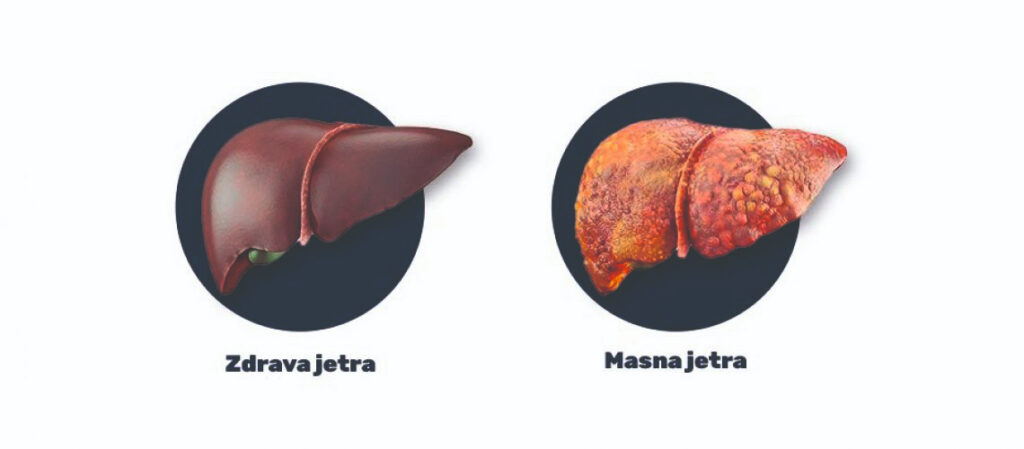
Sindrom goveđe masne jetre
Kod mliječnih krava prekomjerna mobilizacija masnog tkiva tijekom rane laktacije oslobađa dugolančane masne kiseline tijekom razdoblja neadekvatnog unosa energije. Kad brzina unosa lipida iz krvi u jetru premašuje brzinu oksidacije masnih kiselina uz izlučivanje lipida u jetri, velika količina masti se akumulira u jetri i uzrokuje jetrenu lipidozu (sindrom masne jetre). Zahvaćene krave imaju veću vjerojatnost da će patiti od metaboličkih, zdravstvenih i proizvodnih problema prije poroda, kao što su mliječna groznica, ketoza, oštećena funkcija jetre, nizak unos hrane, mastitis, metritis, smanjena laktacija i smanjena reproduktivna sposobnost.
Sindrom masne jetre obično se javlja kod debelih visokoproduktivnih krava, a smrtnost iznosi čak 25%. Unatoč nazivu ovog metaboličkog poremećaja, oboljele krave ne moraju uvijek imati vidljivu prekomjernu težinu u vrijeme teljenja. Prevencija pretilosti ili prekomjerne tjelesne mase ključna je za smanjenje učestalosti sindroma goveđe masne jetre. Kao i za nepreživače, dodatak obrocima s citrulinom ili argininom zaštićenim u buragu može stimulirati jetrenu oksidaciju masnih kiselina. Sve kako bi se smanjio rizik od dislipidemije u krava u laktaciji. Neki od terapeutskih tretmana u sprječavanju sindroma masne jetre mogu uključivati: intravenoznu primjenu glukoze (60 g/h) i KCl; intramuskularnu primjenu protamin cink inzulina te oralna primjena propilen glikola (kao prekursora glukoze; 0,5-1 l/dan).
Ketoza mliječnih krava u laktaciji
Ketoza se odnosi na povišene koncentracije ketonskih tijela (acetoacetata, β-hidroksibutirata i acetona) u krvi zbog pretjerane oksidacije masnih kiselina u acetil-CoA u odnosu na oksidaciju acetil-CoA u CO2 i vodu u mitohondrijima. Ovaj metabolički poremećaj obično se javlja kod krava tijekom rane laktacije. Tad je njihov apetit smanjen nakon teljenja, a unos energije hranom ne može zadovoljiti sve veće metaboličke potrebe za proizvodnjom mlijeka.
Ovo razdoblje negativne energetske bilance utječe na sve krave. One mobiliziraju svoje rezerve masti kako bi zadovoljile energetske potrebe mozga, mliječne žlijezde u laktaciji, mišića i drugih tkiva. Čimbenici koji smanjuju unos hrane i ometaju glukoneogenezu povećat će rizik od ketoze. Liječenje se treba temeljiti na primarnom uzroku negativne energetske bilance i ketoze. Povećanje koncentracije glukoze u plazmi oralnom primjenom propilen glikola (npr. 0,3-0,9 l/dan) ili intravenskom primjenom 250 g glukoze (tj. 0,5l 50% dekstroze) može pomoći u ponovnom uspostavljanju fizioloških koncentracija glukoze u krvi i inhibiciji jetrene ketogeneze. Metabolizam glukoze stvara oksaloacetat, koji olakšava ulazak acetil-CoA u Krebsov ciklus za oksidaciju. Time se smanjuje pretvaranje acetil-CoA u ketonska tijela.
Sindrom niske masnoće mlijeka (depresija mliječne masti) u mliječnih krava
Ovaj poremećaj se odnosi na smanjenje koncentracije mliječne masti (do 50% ili više) s malom ili nikakvom promjenom koncentracije laktoze ili proteina u mlijeku. Zahvaćene krave u laktaciji često jedu hranu s niskim sadržajem vlakana, ali visokim sadržajem koncentrata i nezasićenih masnih kiselina. Kod krava koje pasu, smanjenje mliječne masti može se pojaviti u određenim kritičnim razdobljima u godini (npr. rano proljeće i jesen) i u regijama gdje trave na pašnjacima sadrže nizak sadržaj vlakana.
Ove krave imaju jako nizak pH buraga i njihov burag proizvodi relativno veliku količina trans-10, cis-12 konjugirane linolne kiseline (CLA) koja inhibira sintezu masnih kiselina u epitelnim stanicama vimena. Koncentracija trans-10, cis-12 CLA u sirištu od 0,2 g/100 g ukupnih masnih kiselina može potaknuti smanjenje mliječne masti. Ovaj hranidbeni problem može se spriječiti ili osiguravanjem odgovarajućeg unosa hranidbenih vlakana ili dodavanjem, u buragu zaštićene, palmitinske kiseline obroku mliječnih krava.

Graviditetna toksemija
Kad brzina jetrene oksidacije masnih kiselina u acetil-CoA premašuje onu acetil-CoA u CO2 i vodu u gravidnih jedinki, velike količine acetil-CoA pretvaraju se u ketonska tijela u jetri, što rezultira ketozom. Toksemija tijekom graviditeta najčešća je kod ovaca koje nose više plodova, tijekom zadnje trećine gravidnosti. Tada opskrba hranom i ugljikohidratima, zbog nedovoljne hranidbe ne može zadovoljiti potrebe majke i njezinih plodova. Ovaj metabolički poremećaj javlja se i kod drugih sisavaca, kao što su tovne krave, mliječne krave, psi i gravidne kobile.
U ovaca i koza, rizici od toksemije u graviditetu se povećavaju kad su koncentracije glukoze u majčinoj plazmi manje od 30 mg/100 ml. To je niže od normalnih vrijednosti od 40-60 mg glukoze/100 ml. Zbog prekomjerne mobilizacije masti za stvaranje slobodnih masnih kiselina, pretjerano debele ovce i koze također su osjetljive na graviditetnu toksemiju u stresnim uvjetima, kao što su hladno vrijeme, jaka kiša ili transport. Učestalost ove bolesti može se svesti na minimum pažljivim liječenjem i pravilnom hranidbom. Za prevenciju graviditetne toksemije, kako bi se povećala proizvodnja glukoze u jetri, mogu se obrocima dodati melasa ili žitarice. Liječenje može uključivati oralni propilen glikol ili kukuruzni sirup (kao brzi izvor energije i glukoze) u količini od 0,2l četiri puta dnevno zajedno s 3 do 4l otopine elektrolita.
Bolest žute masti
Ovu bolest (također nazvanu steatitis ili pansteatitis) karakterizira izrazita upala bijelog masnog tkiva, peroksidacija lipida i taloženje “ceroidnog” pigmenta u adipocitima, što rezultira gumastom teksturom i žućkastim izgledom masnog tkiva. Mogući patološki čimbenik je prekomjeran unos oksidiranih nezasićenih masnih kiselina u pokvarenoj prehrani, uz manjak vitamina E ili drugih antioksidansa. Bolest, koja može biti praćena miopatijom, javlja se najčešće u nepreživača (npr. mačke, psi, tvorovi, ribe, ždrebad, konji, kune, svinje, perad, kunići, štakori i gmazovi), a rijetko u preživača. Poremećaj se može liječiti oralnom primjenom vitamina E (npr. 15 odnosno 30 mg/dan za kune i mačke), zajedno s uklanjanjem štetnih nezasićenih masnih kiselina iz obroka.

Hiperamonemija
Nakupljanje amonijaka u plazmi vrlo je toksično za mozak i druge organe (kao što su jetra i bubrezi). Također dovodi do oksidativnog stresa iscrpljivanjem staničnog glutationa. Kad opskrba aminokiselinama iz hrane uvelike premašuje njihovu iskorištenost od strane životinje, te hranjive tvari se oksidiraju i stvaraju velike količine amonijaka u tijelu. Alternativno, kod sisavaca, kad je jetreni ciklus ureje (glavni put za detoksikaciju amonijaka) neučinkovit, zbog urođenih mana ili hranidbenih čimbenika (npr. slaba dostupnost arginina, N-acetilglutamata, mangana ili vitamina B6), također se javlja hiperamonemija.
Sisavci koji ne sintetiziraju arginin (kao što su mačke, kune i tvorovi) ili novorođenčad sisavaca koja imaju ograničenu sposobnost sintetiziranja arginina (npr. svinje, ovce i goveda) za održavanje jetrenog ciklusa uree, ovise o dovoljnom unosu arginina hranom. Stoga je hiperamonemija čest uzrok morbiditeta i mortaliteta ovih navedenih vrsta životinja. Osim toga, u preživača, brza hidroliza uree pomoću bakterijske ureaze u buražnoj tekućini, radi stvaranja amonijaka u odnosu na iskorištavanje amonijaka za mikrobnu sintezu proteina, također dovodi do hiperamonemije, stanja poznatog kao toksičnost uree. Treba napomenuti da su goveđi, ovčji i svinjski embriji vrlo osjetljivi na povišene razine amonijaka.
Na primjer, u usporedbi s 12% sirovim proteinom (SP) u obroku, hranjenje nazimica obrocima s 14% i 16% SP povećava koncentraciju amonijaka u majčinoj plazmi i smanjuje broj živorođene prasadi. U nekim slučajevima, neravnoteža ili antagonizam aminokiselina može dovesti do oslabljene sinteze proteina, povećane oksidacije aminokiselina u amonijak i na kraju do hiperamonemije. Stoga je hranidbena opskrba svim proteinogenim aminokiselinama u dovoljnim količinama i omjerima s obzirom na druge hranjive tvari (osobito mangan, kofaktor arginaze) ključna za prevenciju i liječenje hiperamonemije. Ovaj se cilj može postići uključivanjem relativno male količine sintetskih aminokiselina ili proteina životinjskog podrijetla (npr. riblje brašno, sirutka u prahu, riblja pasta, sir u prahu i brašno od insekata) u primarno biljnoj hranidbi domaćih životinja.
Giht
Giht je poremećaj uzrokovan povišenim razinama mokraćne kiseline (metabolita amonijaka, glicina, aspartata i glutamina) u plazmi zbog povećanog unosa proteina, nedostatka arginina i/ili neaktivne arginaze. Pri visokim razinama, mokraćna kiselina kristalizira u zglobovima, tetivama i okolnim tkivima, što rezultira crvenilom, osjetljivim, vrućim i natečenim tkivom. Ovisno o vrsti, mokraćna kiselina se razgrađuje enzimskim reakcijama na alantoin ili se izlučuje iz tijela. Giht se često javlja kod ljudi, drugih čovjekolikih majmuna i ptica (tj. vrsta koje nemaju urikazu za razgradnju mokraćne kiseline). Rijedak je kod većine drugih životinja s aktivnom urikazom. Smanjenje unosa proteina hranom i povećanje uklanjanja amonijaka može smanjiti proizvodnju mokraćne kiseline i učestalost gihta kod osjetljivih vrsta.
Melanoza
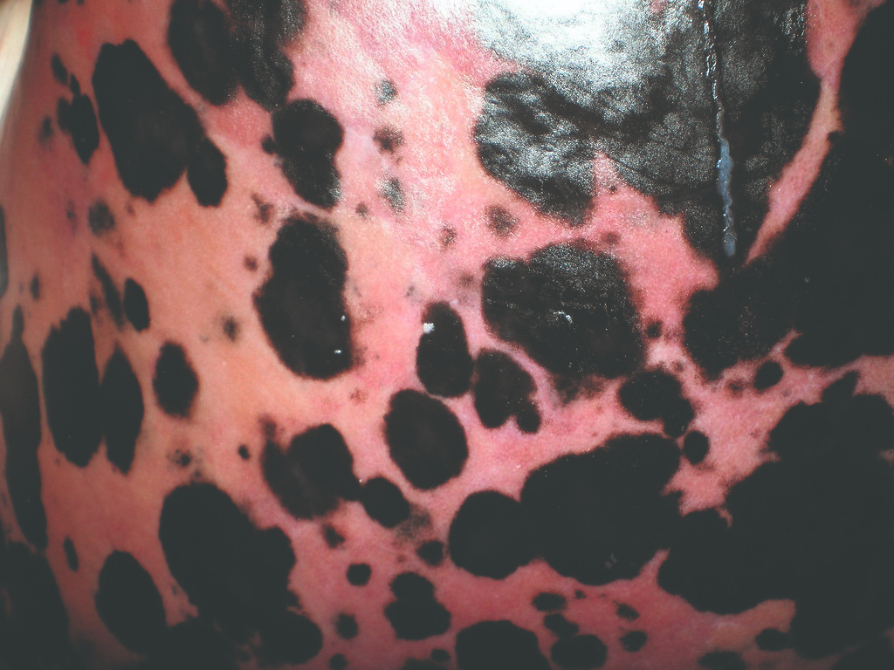
Ovaj poremećaj karakterizira taloženje smeđe-crnog pigmenta npr. melanina ili tvari sličnih melaninu u tkivima, poput kože, mliječne žlijezde, masnog tkiva i limfnih čvorova. Melanoza je nasljedna ili stečena bolest. Češći je kod svinja nego kod drugih vrsta životinja, a ozbiljan je problem kod rakova koji se uzgajaju na farmama. Zanimljivo je da se melanoza javlja i kod mladih preživača (npr. teladi i janjadi). Granule melanina ili srodnih tvari proizvode i otpuštaju melanociti te ulaze u krvotok da bi se prenijele na udaljena mjesta u tijelu.
Abnormalno skladištenje melanina ili srodnih tvari može biti rezultat abnormalnih procesa njegove proizvodnje, transporta ili oboje. Zanimljivo je da genski predisponirane pasmine svinja (npr. Nero Siciliano svinja u Italiji) razvijaju melanozu nakon konzumiranja žira. Vjerojatno je to zbog oksidacije njegovih obilnih fenolnih supstrata tirozinazom koja djeluje i na tirozin i na polifenole. Imajte na umu da pigmentacije mogu negativno utjecati na senzorne značajke mesa i njegove utrživosti, ali ne predstavljaju zdravstveni rizik za potrošače.
Mliječna groznica (postporođajna hipokalcemija ili porođajna pareza)
Ovo je poremećaj uglavnom kod krava u laktaciji nakon teljenja. To je metabolički poremećaj uzrokovan niskom koncentracijom kalcija u krvi (<1,25 mM). Fosfati Ca2+ glavni su minerali u kostima koji štite unutarnje organe i osiguravaju strukturni integritet tijela. Osim toga, mnogi enzimi i proteini zahtijevaju Ca2+ za svoje biološke aktivnosti. Stoga je Ca2+ važan drugi glasnik u stanicama. Konačno, Ca2+ je neophodan za kontrakcije skeletnih mišića, otkucaje srca, prijenos živaca i maksimalnu proizvodnju mlijeka u mliječnim žlijezdama krava u laktaciji. Mliječna groznica može se pojaviti kod krava u laktaciji ubrzo nakon teljenja zbog nedostatka Ca2+. Ovaj metabolički poremećaj karakteriziraju niske koncentracije Ca2+ u krvi. To uzrokuje hiperekscitabilnost živčanog sustava i oslabljene mišićne kontrakcije, mišićne spazme i u teškim slučajevima, paralizu i nesvjesticu.
Intravenska primjena kalcijevog glukonata ili vitamina D zajedno s ravnotežom kationa i aniona u hranidbi pomaže vratiti koncentracije Ca2+ u plazmi i izliječiti ovaj poremećaj. Prevencija mliječnoj groznici predstavlja poseban pristup hranidbe krava u tranziciji, tri tjedna prije i nakon teljenja. Krave se tada hranje obrocima smanjene koncentracije Ca2+ te krmivima na bazi kiselinsko-bazične ravnoteže. Sve kako bi organizam bio spreman iskoristiti tjelesne rezerve ovog minerala, odnosno kako bi se izbjegla pojava mliječne groznice.
Sindrom nedostatka fosfora
Kod životinja većina sindroma nedostatka fosfora (P) slična je sindromima nedostatka vitamina D. Nedostatak fosfora obično se javlja kod životinja koja pase bez dodavanja fosfata. Hranjenje krmivima (npr. lucernom) koje sadrži visok sadržaj Ca, ali nizak sadržaj P može pogoršati nedostatak P u preživača. Životinje s nedostatkom P pokazuju hemolizu, umor, neplodnost, smanjenu kontraktilnost miokarda, slabost mišića, zatajenje disanja, tremor, ataksiju, anoreksiju, mučninu i povraćanje.
Pašna tetanija
Ovaj metabolički poremećaj uglavnom pašnih preživača uzrokovan je niskom koncentracijom magnezija (Mg) u krvi i cerebrospinalnoj tekućini (<0,4 mM u plazmi, hipomagnezijemija). Važno je napomenuti da se niska koncentracija Ca2+ u krvi često javlja istodobno s nedostatkom Mg2+ kod oboljelih životinja. Kao što naziv implicira, pašna tetanija javlja se kod preživača koji konzumiraju krmiva kojima nedostaje Mg2+. To su npr. talijanski ljulj, strna žita (kao što su zob, raž i pšenica) i višegodišnje trave u hladnoj sezoni (kao što je visoka vlasulja) u kasnu zimu i rano proljeće. Pašna tetanija se također javlja kada su koncentracije kalija (visoki unos hranom) i NH4+ u krvi povišene, da bi se smanjila apsorpcija Mg2+ u buragu i kad je unos natrija hranom nizak da bi se ometale fiziološke funkcije.
Ovaj metabolički poremećaj najčešće pogađa goveda koja pasu (osobito najproduktivnije životinje u stadu) tijekom kasnog graviditeta ili rane laktacije (npr. unutar prvih 60 dana nakon teljenja) kad su njihove potrebe za Mg2+ znatno povećane. Kako bi se smanjio rizik od travne tetanije, osjetljivi preživači ne bi trebali pasti bujnu, nezrelu krmu koja ima malo Mg2+, ali visok sadržaj kalija. Njihovi pašnjaci bi trebali dobiti dovoljno Mg2++, ali ne i visoku razinu gnojidbe dušikom.
Osim poboljšanja u upravljanju pašnjacima, hranidbeni tretman za travnatu tetaniju uključuje dodatke Mg2+, NaCl i kalcija, kao što je dnevno davanje oko 85 -110 g mineralnih smjesa koje sadrže 12% – 15% MgO. U hitnim slučajevima, oboljele krave mogu primiti intravensku primjenu 2 – 3g of Mg2+ (tijekom najmanje 10-minutnog razdoblja kako bi se izbjegla potencijalna kardiotoksičnost) u obliku MgSO4 ili magnezijevog i kalcijevog glukonata.

Anemija
Ovo stanje može biti posljedica nedostatka željeza, koje je najzastupljeniji mineral u tragovima kod životinja. Željezo je neophodno za eritropoezu, stvaranje hemoglobina i mioglobina, metaloenzima i citokroma. Gravidne ženke vrlo su osjetljive na nedostatak željeza zbog brzog povećanja volumena tjelesnih tekućina i brzog rasta fetusa. Isto tako, u usporedbi s odraslima, novorođenčad je osjetljivija na nedostatak željeza zbog brzog rasta tkiva.
Među domaćim životinjama, prasad koja se uzgaja u zatvorenom prostoru ili koja je u potpunosti ovisna o hranidbi koja se temelji na mlijeku bez dodataka, posebno je osjetljiva na anemiju. Svinje se rađaju s vrlo ograničenim rezervama željeza i rastu vrlo brzo tijekom neonatalnog razdoblja, a mlijeku krmače nedostaje željeza. Stoga novorođena prasad mora primiti intramuskularnu injekciju od 200 mg željeza (u obliku kompleksa željezo-dekstran) u prvih nekoliko dana nakon rođenja. Zbog bitne uloge željeza u prijenosu i skladištenju kisika, kao i metabolizmu energije, životinje s nedostatkom željeza pokazuju anemiju, ekstremni umor, slabost, nedostatak daha, vrtoglavicu, blijedu kožu, bol u prsima, ubrzan rad srca, hladne noge, i neobičnu žudnju za prljavštinom (nastran apetit).
Toksičnost bakra
Bakar je jak oksidans i njegov višak kod životinja uzrokuje bolove u trbuhu, mučninu, proljeve i oštećenja tkiva. Sadržaj bakra u hrani mora se smanjiti kako bi se izliječila toksičnost bakra. Uz to, životinje (npr. ovce) s toksičnošću bakra mogu oralno primiti ili D-penicilamin (50 mg/kg tjelesne mase) jednom dnevno ili molibden (10 mg/kg tjelesne mase dva puta dnevno). Sigurne razine tiomolibdata i/ili sumpora također se mogu ili nadopuniti hranom kako bi se spriječila intestinalna apsorpcija bakra ili primijeniti intravenozno.
Hipervitaminoza A
Toksičnost vitamina A javlja se kad je kapacitet proteina koji veže retinol za vezanje vitamina A prekoračen. Tada su stanice izložene visokim koncentracijama nevezanog retinola ili retinoične kiseline. Nakupljanje prekomjerne količine vitamina A oštećuje tkiva. Simptomi hipervitaminoze A uključuju tešku fibrozu jetre, oštećenje kostiju i očiju I gubitak dlake. Uzrokuju još i razdražljivost, mučninu, povraćanje i pojavu urođenih mana mladunčadi.
Hipervitaminoza D
Prekomjerna količina vitamina D potiče patološka povećanja u crijevnoj apsorpciji kalcija i mobilizaciji kalcija iz kostura (resorpcija kostiju). To dovodi do neispravne mineralizacije ili metastatske kalcifikacije u tkivima (npr. velike arterije, miokard, želučana sluznica, pluća i bubrezi). Na staničnoj razini, prekomjerna količina 25-hidroksivitamina D (metabolita vitamina D) može vezati receptore vitamina D da stimulira transkripciju gena. Također se natječe i istiskuje 1,25-dihidroksivitamin D iz proteina koji veže vitamin D. Sve kako bi se povećala koncentracija “slobodnog” 1,25-dihidroksivitamina D, što dovodi do njegovog abnormalnog biološkog djelovanja. Stoga, poput hipovitaminoze D, hipervitaminoza D također može rezultirati rahitisom. Drugi simptomi toksičnosti vitamina D su žeđ, svrbež, proljev, malaksalost, gubitak težine, poliurija, slab apetit, neurološki poremećaji, hipertenzija, mučnina, povraćanje.
Hipervitaminoza E
Kad se tokoferol oksidira, on postaje vrsta slobodnih radikala. Stoga visoke razine vitamina E u hranidbi mogu biti toksične za sve životinje. Sindromi hipervitaminoze E kod životinja uključuju oštećenja jetre i prekomjerno nakupljanje bijele masnoće; atrofije testisa; spor razvoj sekundarnih spolnih karakteristika; teratogeni učinci; slab rast, abnormalna kalcifikacija kostiju, povećana retikulocitoza i smrtnost embrija.
Hipervitaminoza K
Vitamin K3 je oksidans koji se također može podvrgnuti monovalentnoj redukciji u semikinonski radikal. Zatim se dalje oksidira pomoću O2 u kinon uz stvaranje superoksidnog aniona. U visokim koncentracijama vitamin K3 u krvi oksidira hemoglobin u methemoglobin. Također uzrokuje nestabilnost eritrocita, hemolizu i fatalnu anemiju, kao i žuticu, hiperbilirubinemiju i kernikterus u novorođenčadi. Razdražljivost, mučnina, povraćanje i bubrežna toksikoza također se javljaju kao odgovor na hipervitaminozu K.
Ovdje nismo opisali mnoga stanja poput poremećaja uzrokovanih abnormalnim metabolizmom, nedostatkom ili viškom ugljikohidrata, viškom lipida i proteina. Zatim poremećaje uzrokovane nedostatkom ili viškom minerala, ili vitamina (osim nekoliko spomenutih). U nekim od sljedećih članaka bit će obrađene i spomenute teme.









